Биологический диктант по теме Биосинтез белка. Фотосинтез. 9 класс
Биологический диктант по теме "Биосинтез белка. Фотосинтез". 9 класс.
Оценить 405 0Биологический диктант по теме «Биосинтез белка в клетке. Биосинтез углеводов в клетке»
для 9 класса (УМК И.Н. Пономарева)
Что такое биосинтез
Что такое фотосинтез
Как называется первый этап биосинтеза белков
Как называется второй этап биосинтеза белков
Где осуществляется второй этап биосинтеза белков?
Где осуществляется первый этап биосинтеза белков?
Что такое транскрипция?
Что такое трансляция?
Какие компоненты участвуют во втором этапе биосинтеза белка?
Какие компоненты участвуют в первом этапе биосинтеза белка?
Какие вещества образуются в световую фазу фотосинтеза?
Какие вещества образуются в темновую фазу фотосинтеза?
Как называется внутренняя среда хлоропласта?
В какой части хлоропласта расположены молекулы хлорофилла?
Где осуществляется световая фаза фотосинтеза?
Где осуществляется темновая фаза фотосинтеза?
Перечислите факторы, влияющие на ход процесса фотосинтеза.
В чем сущность генетического кода?
Назовите ученого, который внес вклад в изучение процесса фотосинтеза.
Как называются тилакоиды, собранные в стопки?
Для скачивания материалов с сайта необходимо авторизоваться на сайте (войти под своим логином и паролем)
Если Вы не регистрировались ранее, Вы можете зарегистрироваться.
После авторизации/регистрации на сайте Вы сможете скачивать необходимый в работе материал.

Заказать рецензию на методическую разработку
можно здесь

Оказание первой помощи в образовательных учреждениях Пройти обучение































- Свидетельство о регистрации средства массовой информации ЭЛ № ФС 77 — 58841 от 28 июля 2014 года выдано Федеральной службой по надзору в сфере связи, информационный технологий и массовых коммуникации (Роскомнадзор).
- Лицензия на осуществление образовательной деятельности № 4276 от 19.11.2020 года. Серия 78 ЛО № 0000171 Выдана Комитетом по образованию Правительства Санкт-Петербурга
- В соответствии с Федеральной целевой программой развития системы образования на 2011–2015 гг. и проектом концепции федеральной целевой программы развития образования на 2016–2020 гг.
БИНАРНЫЙ УРОК ПО БИОЛОГИИ НА ТЕМУ: «БИОПОЛИМЕРЫ (БЕЛКИ), ИХ СТРОЕНИЕ И ОСНОВНЫЕ СВОЙСТВА
Тема урока: Биополимеры (белки), их строение и основные свойства. Роль в живых организмах.
С полным основанием можно утверждать,
что белки - самые важные из всех веществ,
входящих в состав организмов животных
Цель - ознакомить учащихся с природными полимерами - белками. Раскрыть биологическое значение в жизни человека. Дать характеристику как важнейшим составляющим частям пищи. Способствовать развитию познавательного интереса; формировать навыки сотрудничества, коллективного взаимодействия .
углубить знания об особенностях строения белков,
изучить свойства белков,
развивать логическое мышление, умение сравнивать, обобщать, анализировать, делать выводы, развивать экспериментальные навыки, умение работать в малых группах,
воспитать сознательное отношение к здоровому образу жизни,
Тип: урок изучения нового материала.
Вид: бинарный интегрированный урок, интерактивный
Методы: иллюстративный, проблемный, практический
Формы работы: работа в группах, лабораторный опыт.
Оборудование: компьютер, мультимедийный проектор, держатели, штатив с пробирками, песок, ступка, технологическая карта опыта, оценочный лист.
Реактивы: раствор белка куриного яйца, этанол; образцы растительной и животной пищи (картофель вареный, картофель сырой, мясо вареное, мясо сырое), пероксид водорода.
Контроль качества первичного усвоения знаний
Формы и методы работы
Приветствие, проверка отсутствующих, объединение в группы, представление эксперта и лаборанта
Эксперт сообщает об отсутствующих и готовности к уроку,
Биолог: Постановка проблемы, сообщение цели и задач урока,
Записывают тему урока в рабочую тетрадь, задумываются о проблеме
Актуализация опорных знаний (полученных на уроках химии в 9 классе)
что такое белки
что является мономерами белка
какие функциональные группы входят в состав аминокислот
что такие заменимые и незаменимые аминокислоты
что такое полноценные и неполноценные белки
с помощью каких связей молекулы аминокислот соединяются в макромолекулу белка
какие вы знаете структуры белка
охарактеризуйте первичную структуру белка
охарактеризуйте вторичную структуру белка
охарактеризуйте третичную структуру белка
Биолог: меняет слайды
Химик: подводит итог этапа
Отвечают с места, оценивают ответы цветными карточками, эксперты заносит оценки в оценочный лист
Изучение нового материала
Объяснительно-иллюстративный, лабораторный опыт,
Биолог: называет свойства (растворимость, денатурация, деструкция) белков.
Химик: демонстрирует опыт по растворимости и химической деструкции белков.
Биолог: перечисляет функции белков в клетке.
Выводит на экран опорные схемы.
Химик: Проводит инструктаж по безопасности перед проведением лабораторного опыта, следит за выполнением опыта, подсказывает при формировании выводов.
Записывают опорные схемы в тетрадь,
Смотрят демонстрационный опыт
Записывают опорные схемы в тетрадь
Проводят лабораторный опыт,
Заполняют инструктивную карту, делают вывод.
Эксперты собирают карты, передают учителю для оценивания.
Контроль качества первичного усвоения знаний
Работа с учебником
Раздает карточки, указывает параграф, который необходимо проработать
Читают учебник и заполняют таблицу на карточках
Показывает картинки настроения, за которые необходимо проголосовать
Голосуют поднятием руки
Корректирует ответы учащихся и окончательно формулирует вывод, сообщает оценки.
Формулируют ответ на проблемный вопрос, на основании полученных на уроке знаний
Сообщает домашнее задание: изучить параграф 4, упражнение 1-5 на с. 29
Записывают задание в дневник
ВОПРОСЫ ДЛЯ АНАЛИЗА РЕЗУЛЬТАТОВ ЛАБОРАТОРНОГО ОПЫТА:
1.В каких пробирках проявилась активность ферментов? Почему?
2.Как проявляется активность фермента в живых и мёртвых тканях?
3.Различается ли активность фермента в растительных и животных тканях?
4.Как влияет измельчение ткани на активность фермента? Практическое значение имеет этот опыт?
§ 3. Биополимеры. Белки, их строение
Состав белков. Белки — обязательная составная часть всех клеток. В состав этих биополимеров входят мономеры 20 типов. Такими мономерами являются аминокислоты, которые получили свое название потому, что содержат и аминогруппу (—NH2), и кислотную карбоксильную группу (—СООН). Каждая из 20 аминокислот имеет одинаковую часть, включающую обе эти группы и отличается от любой другой особой химической группировкой, так называемой R-группой, или радикалом (рис. 4).
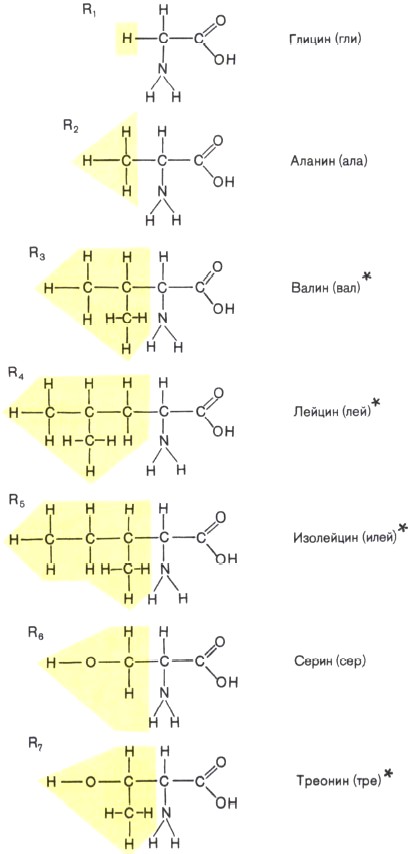
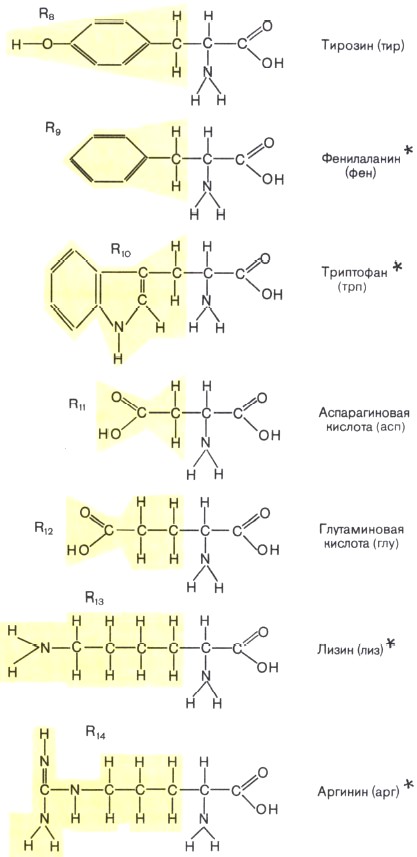
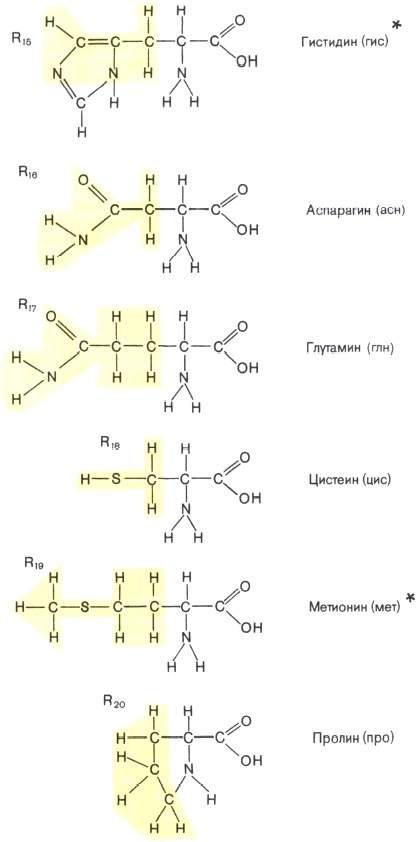
Рис. 4. Строение аминокислот — мономеров белковых молекул. Желтым цветом выделены радикалы (R). Звездочками помечены незаменимые аминокислоты, которые не синтезируются в клетках человека, а должны поступать в организм с пищей
Образование линейных молекул белков происходит в результате соединения аминокислот друг с другом. Карбоксильная группа одной аминокислоты сближается с аминогруппой другой, и при отщеплении молекулы воды между аминокислотными остатками возникает прочная ковалентная связь, называемая пептидной (рис. 5). Соединение, состоящее из большого числа аминокислот, называется полипептидом. Каждый белок по своему химическому строению является полипептидом. Некоторые белки состоят из нескольких полипептидных цепей. В составе большинства белков находится в среднем 300—500 остатков аминокислот. Известно несколько очень коротких природных белков, длиной в 3—8 аминокислот, и очень длинных биополимеров, длиной более чем в 1500 аминокислот.
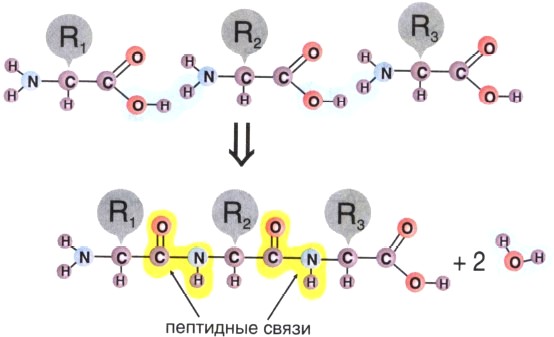
Рис. 5. Соединение аминокислот в полипептидную цепь
Строение белков. Выделяют первичную, вторичную, третичную и четвертичную структуры белков (рис. 6).
Первичная структура (рис. 6, I) определяется порядком чередования аминокислот в полипептидной цепи. Двадцать разных аминокислот можно уподобить 20 буквам химического алфавита, из которых составлены «слова» длиной в 300—500 букв. С помощью 20 букв можно написать безграничное множество таких длинных слов. Если считать, что замена или перестановка хотя бы одной буквы в слове придает ему новый смысл, то число комбинаций в слове длиной в 500 букв составит 20500.
Известно, что замена даже одного аминокислотного звена другим в белковой молекуле изменяет ее свойства. В каждой клетке содержится несколько тысяч разных видов белковых молекул, и для каждого из них характерна строго определенная последовательность аминокислот. Именно порядок чередования аминокислот в данной белковой молекуле определяет ее особые физико-химические и биологические свойства. Исследователи умеют расшифровывать последовательность аминокислот в длинных белковых молекулах и синтезировать такие молекулы.
В живой клетке многие молекулы белков или их отдельные участки представляют собой не вытянутую нить, а спираль с одинаковыми расстояниями между витками. Такая спираль представляет собой вторичную структуру белковой молекулы (рис. 6, II).
Между группами N—Н и С=0, расположенными на соседних витках, возникают водородные связи. Они намного слабее ковалентных, но, повторенные многократно, скрепляют регулярные витки спирали.
Спираль обычно свернута в клубок. Этот клубок образован закономерным переплетением участков белковой цепи. Положительно и отрицательно заряженные R-группы аминокислот притягиваются и сближают даже далеко отстоящие друг от друга участки белковой цепи. Сближаются и иные участки белковой молекулы, несущие, например, «водоотталкивающие» (гидрофобные) радикалы. В результате взаимодействия различных остатков аминокислот спирализованная молекула белка образует клубок — третичную структуру (рис. 6, III). Для каждого вида белка характерна своя форма клубка с изгибами и петлями. Третичная структура зависит от первичной структуры, т. е. от порядка расположения аминокислот в цепи.
Наконец, некоторые белки, например гемоглобин, состоят из нескольких цепей, различающихся по первичной структуре. Объединяясь вместе, они создают сложный белок, обладающий не только третичной, но и четвертичной структурой (рис. 6, IV).
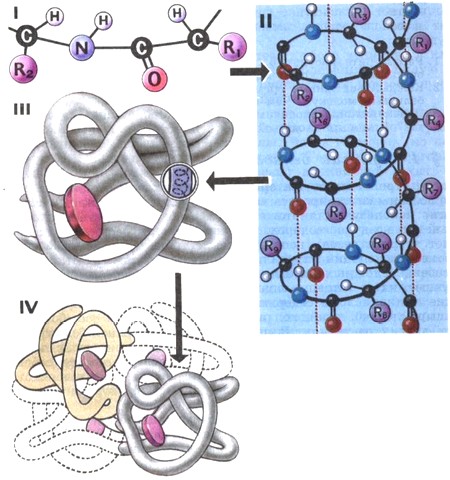
Рис. 6. Схема строения белковой молекулы
I - первичная структура; II - вторичная структура; III - третичная структура; IV - четвертичная структура
Под действием ионизирующей радиации, высокой температуры, сильного взбалтывания, экстремальных значений pH, а также ряда органических растворителей, таких, как спирт или ацетон, белки изменяют свое естественное состояние. Нарушение природной (нативной) структуры белка называют денатурацией. Подавляющее большинство белков утрачивает при этом биологическую активность, хотя первичная структура их после денатурации не меняется. Дело в том, что в процессе денатурации нарушаются вторичная, третичная и четвертичная структуры, обусловленные слабыми взаимодействиями между аминокислотными остатками, а ковалентные пептидные связи не разрываются. Необратимую денатурацию можно наблюдать при нагревании жидкого и прозрачного белка куриного яйца: он становится плотным и непрозрачным. Денатурация может быть и обратимой. После устранения денатурирующего фактора многие белки способны вернуть естественную форму, т. е. ренатурироватъ.
Урок по химии "Белки - биополимеры"
методическая разработка по химии (10 класс) по теме
В материале отражено строение белков, представлено описание структур, химические свойства (горение, пенообразование, цветные реакции).
Скачать:
| Вложение | Размер |
|---|---|
| urok_belki_-_biopolimery_dokument_microsoft_office_word.doc | 53.5 КБ |
Предварительный просмотр:
Тема урока: «Белки - биополимеры»
- формирование знаний о составе и строении белков, их аминокислотном составе, принципе их объединения в полипептидную цепочку
- продолжить развитие у учащихся умения сравнивать состав и строение различных органических соединений (белков, жиров, углеводов)
- продолжить формирование у учащихся убеждённости в познаваемости мира на основе знаний о строении, составе и свойствах органических веществ.
I. Организационный момент
- Приветствие
- Определение отсутствующих учащихся
- Проверка готовности учащихся к уроку
II. Мотивация темы и целей урока:
- Какие вещества называются органическими?
- Какие органические вещества входят в состав клетки?
3. Какие органические вещества мы с вами изучили?
III. Изучение нового материала
Из органических веществ клетки на первом месте по количеству и значению стоят белки. Многообразие живых организмов на нашей планете во многом связано с многообразием белков. Вы, наверно, слышали о проблеме совместимости тканей при пересадке органов от одного организма к другому. Несовместимость связана, с тем, что каждый организм имеет собственный неповторимый набор белков. Наряду с углеводами и жирами белки являются основной составной частью нашей пищи. С белками связаны все жизненные процессы. Они входят в состав клеток и тканей всех живых организмов.
- Транспортная (гемоглобин); 2) Защитная (иммуноглобулины); 3) каталитическая (ферменты); 4. Регулирующая (гормоны);
Рассмотрим строение и свойства белков.
- В отличие от других органических соединений белки обладают
рядом особенностей. Прежде всего, белкам присуща громадная молекулярная масса. Сравните: молекулярная масса спирта – 46, уксусной кислоты – 60, а альбумина (одного из белков яйца) – 36000, гемоглобина – 152000, миозина (белок мышц) – 500000. (Слайд 2)
Ясно, что по сравнению с молекулами спирта, уксусной кислоты и другими веществами молекулы белков великаны. В их построении участвуют тысячи атомов. Для того чтобы подчеркнуть гигантский размер таких молекул, их называют макромолекулами (с греч. “макрос” - большой, гигантский)
- Чтобы представить значение класса белков, обратимся к цифрам.
В одной клетке бактерий кишечной палочки содержится около 5 тыс. молекул органических соединений, из них – 3 тыс. приходится на белки.
В организме человека более 5 млн. белков (50 % массы клетки в расчёте на сухое вещество). Без белков невозможно представить движение, способность расти, сократимость, размножение.
Часто белки называют протеинами – это название подчёркивает первостепенную роль этих веществ (с греч “протео” - занимаю первое место) (Слайд 3)
Ряд ученых занимались изучением строения белков. В 1888 русский биохимик Данилевский указал на то, что в молекулах белков содержится повторяющаяся пептидная группа атомов. В начале ХХ столетия немецкому ученому Эмилю .Г Фишеру удалось синтезировать соединение в молекулы которого входило 18 остатков различных аминокислот, соединенных пептидными связями. Нобелевская премия (1902).
В настоящее время известно, что белки – это сложные высокомолекулярные природные соединения, молекулы которых построены из остатков 20 аминокислот и представляет собой повторяющиеся участки –CH-CO-NH-, составляющих скелет молекул, и отдельных групп-радикалов R, R и R. (Слайд 4)
Белки не удавалось выделить из костной ткани, хрящей, волос, копыт…так как они не переносят нагревания и кристаллизации из горячих растворов.
Поэтому в начале занимались изучением не структуры белка, а химического состава.
В белке следующие химические элементы: С, Н, О, N, S, P, Fe. Железо в гемоглобине крови, фосфор в казеине молока….(Слайд 5)
Массовая доля элементов:
Не значительное количество меди, кальция, цинка, брома, йода.
Содержание белка в некоторых тканях (после обезвоживания органа): Мышцы – 80%; Жировая ткань, кости, зубы – 14 – 28%;
Почки – 72%; Семена растений – 10 – 15 %;
Кожа – 63%; Стебли, корни, листья – 3% - 5%
Печень – 57%; Плоды – 1-2% Мозг – 45%; (Слайд 6)
Состав и классификация белков: (Слайд 7)
По составу различают:
протеины, состоящие только из аминокислот,
протеиды – содержащие небелковую часть,
простые белки – состоят из аминокислот,
сложные – могут включать углеводы (гликопротеиды), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды)
полноценные – содержат весь набор аминокислот
неполноценные – какие–то аминокислоты в их составе отсутствуют
Структура белка (см видео)
Первичная структура - полипептидная цепь, в которой пептидные связи между аминокислотными остатками. (Слайд 8)
Вторичная структура – спираль, поддерживается водородными связями, которая в 15 – 20 раз слабее ковалентной. Данные ренгеноструктурного анализа доказали, что максимальная стабильность молекулы белка обеспечивается множеством водородных связей (работы Л. Полинга, Р. Кори) (Слайд 9)
Третичная структура – глобула, способ укладки спиральных структур в глобулярных белках. (Слайд 10)
В образовании третичной структуры большая роль принадлежит радикалам, за счёт которых образуются дисульфидные мостики, сложноэфирные связи, водородные связи, амидные связи. Компактность белка во многом определяется взаимодействием с водой, так как гидрофобные остатки отталкиваются от молекул воды и стремятся собраться внутри белковой молекулы силами Ван-дер-Ваальса. Интересно отметить, что информация для образования третичной структуры содержится в полипептидной цепи, а дисульфидные мостики только закрепляют третичную структуру (инсулин, рибонуклеаза)
Четвертичная структура – это объединение нескольких трёхмерных структур в одно целое. (Слайд 11)
Классический пример: гемоглобин. В гемоглобине гем - небелковая часть, глобин - белковая часть. Гем одинаков для животных и человека, глобин отличен.
Доказана четвертичная структура амилазы, вируса табачной мозаики, пепсина, инсулина.
- Денатурация (Слайд 12)
Чем выше уровень организации белковой молекулы, тем структура мене прочна.
Нарушение нативной (естественной), уникальной (свойственной только этому белку) структуры белковой молекулы называют денатурацией.
Денатурация может быть вызвана изменением температуры, обезвоживанием, облучением рентгеновскими лучами и другими воздействиями. Вначале разрушается самая слабая структура – четвертичная, затем третичная, вторичная и при наиболее жестких условиях – первичная.
Если при изменении условий среды первичная структура молекулы белка остаётся неизменной, то при восстановлении нормальных условий среды полностью восстанавливается и структура белка.
Процесс восстановления структуры белка называется ренатурацией .
Это свойство белков широко используется в медицинской и пищевой промышленности для приготовления медицинских препаратов, например вакцин и сывороток, для получения пищевых концентратов, сохраняющих в высушенном виде свои питательные функции.
- Растворимость белков. Белки могут быть как растворимы, так и нерастворимы в воде в зависимости от их состава и структуры
(показ растворимости яичного белка в воде)
- Пенообразование ( взбить яичный белок)
- Горение с образованием углекислого газа и воды.
5. Цветные реакции белков: биуретовая, ксантопртеиновая (Слайд 13,14)
Сегодня на уроке мы познакомились с новыми понятиями. (Слайд 15)
IV. Закрепление изученного материала
Тест «Строение белков»
1. Какие химические элементы входят в состав белков?
а) углерод б) водород в) кислород г) сера д) фосфор е) азот ё) железо ж) хлор
2. Сколько аминокислот участвуют в образовании белков?
а) 30 в) 20 б) 26 г) 10
3. Какие белки называются неполноценными?
а) в которых отсутствуют некоторые аминокислоты
б) в которых отсутствуют некоторые незаменимые аминокислоты
в) в которых отсутствуют некоторые заменимые аминокислоты
4. Какие связи стабилизируют первичную, вторичную, третичную структуру? (Соотнесите)
а) ковалентные в) ионные
б) водородные г) такие связи отсутствуют.
5. Функция, при которой гемоглобин переносит кислород из лёгких к клеткам других тканей:

